[월간 글립 vol.5 2020년 9월호] 핵 라미나 질병(Laminopathy) : 핵 구조에 숨어있는 질병의 원인
- GLEAP

- 2020년 9월 1일
- 4분 분량
1966년 A. E. Emery와 F. E. Dreifuss에 의해 세상에 알려진 Emery-Dreifuss Muscular Dystrophy(EDMD)는 골격근과 심장근의 기능이 저하되는 근육위축증(Dystrophy)의 한 종류로, 대표적인 핵 라미나 질병(Laminopathy)에 속한다 [1][2][5] (그림 1.). 핵 라미나 질병은 세포 속 핵막 구조의 돌연변이가 그 원인이 되어 발병되는 것으로 알려져 있다 [1]. 어떻게 핵막 구조의 돌연변이가 심각한 질병으로 이어지는 것일까? 과연 핵 구조와 세포의 기능 사이에는 어떤 연관관계가 숨어있으며, 그 관계를 설명하기 위해 과학자들은 어떤 이론을 제시했을까? 이번 월간 글립 9월 호에서는 핵 라미나 질병과 핵 구조 사이의 관계와 그 원인에 대한 대표적인 두 개의 가설에 대해서 다루고자 한다.

그림 1. (a) 정상 근육 (b) 근육위축증 환자의 근육 (그림 출처 : [6])
핵 라미나(Nuclear lamina)는 핵막의 구조 형성 및 유지에 관여하는 섬유 구조의 네트워크로 핵막 하층이라 불리기도 한다 (그림 2.). 핵 라미나은 핵과 세포의 구조를 안정적으로 유지해주며, 핵막과 염색질(Chromatin) 사이의 결합을 매개하여 유전자의 발현을 조절하는 기능을 수행하는 것으로 알려져 있다 [1]. 아직 핵 라미나의 구체적인 기능에 대해서는 많은 연구가 진행 중에 있지만, 세포가 정상적인 기능을 수행하기 위한 매우 중요한 역할을 하고 있다는 점은 널리 받아들여지고 있다. 그렇다면, 어떤 돌연변이가 핵 라미나에서 관찰되며, 이러한 돌연변이가 핵 라미나 질병으로 이어지는 이유는 무엇일까?

그림 2. 핵막의 구조 및 관련 단백질(그림 출처 : [1])
첫 연구 이후, Emery와 Dreifuss는 EDMD 환자들이 내부 핵막에 에머린(Emerin)이라는 막관통 단백질을 갖고 있지 않음을 관찰했다. 그들은 이러한 핵막 구조의 변화가 질병의 원인이 될 것이라는 아이디어를 내놓았다. 후에 X 염색체에 존재하는 EMD 유전자와 FHL1 유전자의 돌연변이가 이와 관련되어 있음이 밝혀졌다 [1][5]. 또한, 다른 유형의 EDMD환자들에게서는 A-type의 핵 라민(Nuclear lamin)의 발현에 관여하는 LMNA 유전자의 돌연변이가 관찰되면서 (그림 3.), 과학자들은 EDMD가 핵막 단백질과 핵 라민을 암호화하는 유전자의 돌연변이에 의해 나타남을 알 수 있었다 [1][5].

그림 3. LMNA 유전자 11 exon 돌연변이 및 Lamin A 단백질 (그림 출처 : [1])
근육위축증 이외에도 심근증(Cardiomyopathy), 조로증(Premature aging syndrome) 역시 대표적인 핵 라미나 질병에 속하며, 마찬가지로 핵 구조에 관여하는 다양한 단백질의 돌연변이가 관찰된다 [1]. 하지만, 이러한 발견은 우리에게 한 가지 중요한 의문을 불러일으킨다. 핵 라미나 질병을 일으키는 기능 이상은 특정 조직에서만 관찰된다. 핵은 모든 세포에 존재하는데, 핵 구조의 돌연변이는 왜 특정 조직에만 영향을 미칠까? 과학자들은 이를 설명하기 위해서 “물리적 스트레스(Mechanical stress)” 가설과 “유전자 발현 이상(Aberrant gene expression)” 가설을 제시하였다 [1][3][4].
먼저 “Mechanical stress” 가설에 따르면, 핵 라미나의 돌연변이는 핵 구조의 안정성을 떨어뜨리고 핵과 세포골격 간의 연결을 약하게 만든다 [1][4] (그림 4.).
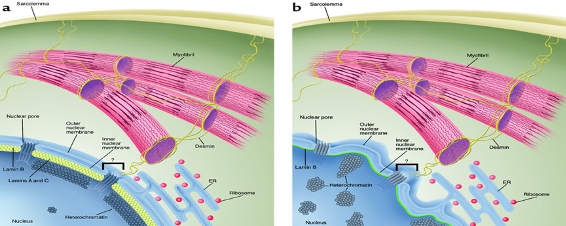
그림 4. (a) 정상 근육 세포의 핵 구조 및 (b) 돌연변이 세포의 핵 구조 (그림 출처 : [4])
세포들은 주변 환경과 상호작용을 하면서 끊임없는 물리적 스트레스에 노출되어 있다. 특히, 근육 세포는 수축과 이완을 반복하면서 상당히 큰 스트레스를 받게 된다. 마치 내진 설계를 해놓은 건물처럼, 정상적인 세포는 스트레스를 비교적 안정적으로 견딜 수 있다 (그림 5.). 하지만, 핵 라미나의 돌연변이가 나타난 세포는 구조적으로 약한 상태이기 때문에 이 스트레스를 견뎌낼 수 없다는 것이다 [1][4]. 결과적으로, 스트레스를 견뎌내지 못한 세포로 인하여 관련 조직의 이상 증상이 나타난다는 것이 이 가설의 핵심이다 [1][4].

그림 5. "Mechanical stress" 가설에 대한 모델 (그림 출처 : [3])
두 번째로, “Aberrant gene expression” 가설은 핵 구조와 유전자 발현 사이의 연관관계에 주목한다. 즉, 정상적인 핵 구조가 형성되어야만 조직 특이적인 유전자 발현을 조절할 수 있다는 것이다 [1][3].

그림 6. 핵 내 염색질 구획화 및 응축 정도에 따른 전사 조절 (그림 출처 : [1])
이 가설이 주목하는 점은 바로 핵 구조와 염색질 사이의 관계이다. 염색질은 응축 정도에 따라서 구분할 수 있으며, 그 중 “잘 풀려있는” 염색질에서 전사가 활발하게 진행될 수 있다 [1]. 이런 염색질을 진정염색질(Euchromatin)이라고 부른다 [1]. 반대로 “뭉쳐 있는” 염색질에서는 전사가 진행되지 않으며, 이를 이질염색질(Heterochromatin)이라고 부른다 [1]. 특히 이질염색질은 단백질을 통해 핵막과 결합하고 있으며, 이를 통해 세포는 전사가 활발하게 진행되는 진정염색질을 특정 구역으로 위치시키고 전사를 조절하게 된다 [1] (그림 6.). 하지만 핵 구조의 돌연변이가 나타난 세포는 이러한 조절 과정을 진행할 수 없게 된다 [1]. 따라서 핵 구조의 돌연변이는 세포의 유전자 발현에 영향을 미쳐, 결과적으로 질병으로 이어진다는 것이 이 가설의 주요 논점이다 [1][3].
두 가설은 서로 독립적인 관점에서 질병의 원인을 설명하려는 시도처럼 보이기도 한다. 하지만 최근에 진행된 관련 연구들은 두 가설 사이의 연결고리가 존재한다는 점을 보여주고 있으며, 두 가설을 상호보완하기 위한 연구들이 활발하게 진행되고 있다. 따라서, 핵 구조의 돌연변이, 유전자 발현 조절, 그리고 세포 구조의 안정성 사이에는 어떤 연결고리가 존재할 것인지 밝혀내는 것이 앞으로의 과제라고 볼 수 있을 것이다.
이번 월간 글립을 통해 살펴보았듯이, 핵 라미나 질병에 관한 연구들은 핵 구조와 그 역할을 밝혀내는데 밑거름이 되었다. 이처럼 원인 불명의 질병은 우리에게 부정적인 영향을 미치기도 하지만, 한편으로는 생명체에 대한 궁금증을 해결해줄 수 있는 중요한 열쇠이기도 하다. 이러한 연구는 치료 기술의 발달뿐만 아니라, 아직 알려지지 않은 생명체의 기능과 역할에 대해 많은 정보를 제공하기 때문이다. 마치 보물 지도의 힌트를 찾아 나가며, 마침내 보물이 있는 곳에 다다르듯이 말이다. 짧은 글이지만, 이번 월간 글립 9월 호가 여러분에게 좋은 호기심 자극제가 되었기를 바라면서 이 글을 마치고자 한다.
[참고문헌 및 그림 출처]
[1] Cooper, G. M., The Cell : A Molecular Approach (8th ed.), New York: Oxford University Press., 2019., pp. 342-348, 356-360.
[2] Emery, A. E., and Dreifuss, F. E., Unusual Type of Benign x-Linked Muscular Dystrophy., Journal of Neurology, Neurosurgery & Psychiatry, Vol. 29, No. 4, 1966., pp. 338–342.
[3] Jonker, A., Laminopathies: A consequence of mechanical stress or gene expression disturbances?., 2017., pp. 1-20.
[4] Worman, H. J., and Courvalin, Jean-Claude. , How Do Mutations in Lamins A and C Cause Disease?., The Journal of Clinical Investigation, Vol. 113, No. 3, 2004., pp. 349–351.
Written by GLEAP 9기 박재형
Edited by GLEAP 학술팀·홍보팀

댓글